No século XVIII, Torricelli mediu pela primeira vez a pressão atmosférica e deu uma explicação adequada à natureza desse fenômeno. Assim, teve início o estudo dos gases. O estudo dos gases é o estudo das relações entre as grandezas macroscópicas dos gases, tais como a pressão, a temperatura e o volume de um gás.
• Os gases tendem a ocupar o volume total de seus recipientes.
• Apresentam alta compressibilidade e expansibilidade.
• Os gases sempre formam misturas homogêneas com outros gases.
• As forças intermoleculares dos gases são muito pouco intensas.
Teoria Cinética Molecular – O Gás Ideal
• Teoria desenvolvidapara explicar o comportamentodos gases em condições ideais.
• Suposições:
– Os gases consistem de um grande número de moléculas em movimento
aleatórioconstante.
– O volume de moléculas individuais é desprezível comparado ao volume do
recipiente.
– As forças intermoleculares (forças entre moléculas de gases) são insignificantes de forma que podem ser desprezadas.
– A energia pode ser transferida entre as moléculas, mas a energia cinética total é constante à temperatura constante.
• A teoria molecular cinética nos fornece um entendimento sobre a pressão e a
temperaturas no nívelmolecular.
• A pressão de um gás resulta do número de colisões por unidade de tempo nas
paredes do recipiente. A ordem de grandeza da pressão é dada pela freqüência e pela força da colisão das moléculas.
• As moléculas de gás têm uma energia cinética média, cada uma com energia
diferente
Variáveis de Estado dos Gases:
1) Pressão (p)
• A pressão é a força atuando em um objeto por unidade de área:
1 atm = 101325 Pa = 760 mm Hg
2) Volume (V)
• O volume é a porção de espaço ocupada pela massa gasosa. No caso dos gases ideais é o próprio volume do recipiente.
3) Temperatura Absoluta (T)
1 L = 1000 mL = 1000 cm3.
1 m3 = 1000 L.
• Variável diretamente proporcional à energia cinética média das moléculas do
sistema.
• Reflete o grau de agitação das moléculas do sistema.
T(K) = t(°C) + 273
Lei geral dos gases perfeitos
A expressão que determina a lei geral para os gases perfeitos pode ser vista da seguinte forma:
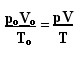
Onde po, Vo e To são respectivamente a pressão inicial, volume inicial e temperatura inicial. Essa é uma expressão que é utilizada para quando as variáveis de um gás apresentar variações.
Transformações Gasosas:
Lei de Boyle
Robert Boyle, físico e químico, foi quem determinou a lei que rege as transformações sofridas por um gás, quando sua temperatura é mantida constante. Sua lei diz que quando um gás sofre uma transformação isotérmica, a pressão dele é inversamente proporcional ao volume ocupado. Dessa lei obtemos que como To = T temos que:
poVo = pV
Lei de Gay-Lussac
A lei de Gay-Lussac é a lei que rege as transformações de um gás perfeito à pressão constante. Essa lei, apesar de levar o nome de Gay-Lussac, já havia sido descoberta pelo físico e químico A.C. Charles. Segundo a lei, quando um gás sofre uma transformação isobárica o volume do gás é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma:
Onde Vo e To correspondem respectivamente ao volume inicial e à temperatura inicial.
Realizada à pressão constante (p = cte).
Lei de Charles
A lei de Charles é a lei que rege as transformações de um gás perfeito a volume constante. Essas transformações são chamadas de transformações isocóricas ou isométricas. Segundo essa lei, quando uma massa de gás perfeito sofre transformação isocórica, a sua pressão é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma:
Onde po e To são respectivamente a pressão inicial e a temperatura inicial.
• Realizada a volume constante (V = cte).
Vídeos do You Tube







Nenhum comentário:
Postar um comentário